年份
The Good(免疫細胞), the Bad(癌細胞), and the Ugly(細菌) — 淺談細菌癌症療法(中研院訊-漫步科研 轉載)
作者:牟昀助研究員(本院生物醫學科學研究所)
“The Good, the Bad, and the Ugly” (中文譯作《黃昏三鏢客》) 是義大利導演賽吉歐.李昂(Sergio Leone)於 1966 年推出的經典西部電影,劇中描述三個性格迥異的主角在追逐寶藏的過程所發生的衝突與趣事。筆者在構思此文時,突然想到這部電影可以用來比擬細菌癌症療法(Bacteria-based cancer therapy)中的三個要角:「免疫細胞 (the Good)」、「癌細胞 (the Bad)」、與「細菌 (the Ugly)」。這三個角色都是活的細胞,競爭著相同的資源,隨時保持著動態的互動關係。就像在電影中,the Good 想要打贏 the Bad,往往還得靠著跟the Ugly 的合作。要如何利用細菌來幫助免疫系統打贏癌症,這就是細菌癌症療法的研究核心。以下筆者試圖淺談這個新興的領域1-3。
第一個活的藥物:CAR-T 療法
講到活的藥物 (live drugs),相信大家對 CAR-T(Chimeric antigen receptor T-cell therapy,中文譯作嵌合抗原受體 T 細胞療法)並不陌生。在 2010-2011 年,美國的三個團隊(Steven Rosenberg, Carl June, and Michel Sadelain)分別發表了三篇臨床論文,證明 anti-CD19 CAR-T therapy 對於 B 細胞血癌有極佳的療效 1-3。 例如,小女孩艾蜜莉 (Emily Whitehead) 是人類歷史上第一位接受 CAR-T 治療的孩童。她在 6 歲時罹患了血癌末期,經歷各種治療都失敗後,她嘗試了 CAR-T 的臨床試驗,成功「治癒」了她的癌症,如今已經十年沒有復發,網路上可以看到她每年慶祝 cancer-free 的可愛照片。像艾蜜莉這樣成功的例子並不罕見,根據最近的統計,CAR-T 療法對於適應症的成功率達到了 50-80%,其中多數病人 (30-40%) 都可以得到長期的無癌生存。基於如此優異的藥效,美國食藥署在 2017 年正式核准了兩支 CAR-T 藥物 (Kymriah and Yescarta),適用於多種 B 細胞血癌治療。
CAR-T 療法是將病人血液中的 T 細胞取出,在實驗室裡透過基因工程的方式改造,使其能辨識特定癌症抗原 (例如 B 細胞血癌的CD19),再將改造後的 T 細胞注回病人體中,行使攻擊癌細胞的任務。由於 CAR-T 是活的細胞,進入人體後,在癌症抗原的刺激下,會不斷再生,產生更多 CAR-T 細胞來攻擊癌細胞。比起傳統的藥物治療,需要長期多次的投藥, CAR-T 原則上僅需要一次性的治療 (基於安全考量, 實際臨床操作通常是一周內進行 2-3 次 CAR-T 注射,從低劑量到高劑量,避免強烈的副作用產生),就可以達到終身的療效。值得一提的是,如果選擇使用以 4-1BB 作為 co-stimulation domain 的Kymriah, CAR-T 細胞除了在投藥一個月內會大量增生以外,隨後 CAR-T 會分化成 memory T 細胞,少量並長期地存在人體內,最高紀錄在治療超過十年的病人體內仍能偵測到 CAR-T 的存在,這可能解釋了為何 CAR-T 能長期防止癌症復發的機制 4。
什麼?細菌能治癌症?
如果要簡述一下人類對抗癌症的歷史 (圖一 ),人類從公元前 3000 年就有記載使用切除的方式來治療癌症。一直到了 20 世紀初期,由於居里先生與夫人發現了 X-ray,放射治療才成為了外科手術以外第二個醫界認可的癌症療法。到了 20 世紀中葉,化療藥物開始興盛,成為癌症治療的主流,但其強烈的副作用往往令病人望之卻步。 1980 年代開始,科學家發展出標靶治療,其中包括小分子藥物的 tyrosine kinase inhibitors 以及大分子藥物的抗體。標靶藥物的出現,大大降低了癌症治療的副作用,是癌症病患的一大福音。然而不論是放射治療、化學治療、還是標靶治療,往往都只能延緩癌症的進程,無法真正「治癒」癌症。直到 2010 年代,由於免疫檢查點 (immune checkpoint) 的發現,免疫檢查點抑制劑在多種癌症病人身上展現卓越的療效,約莫有 20% 的病人能達到長期緩解的效果。再加上 2017 年獲准的 CAR-T 能有效治癒血癌,人類終於發現對抗癌症最佳的武器就是自身的免疫系統,「免疫療法」(immunotherapy) 的紀元正式開始。
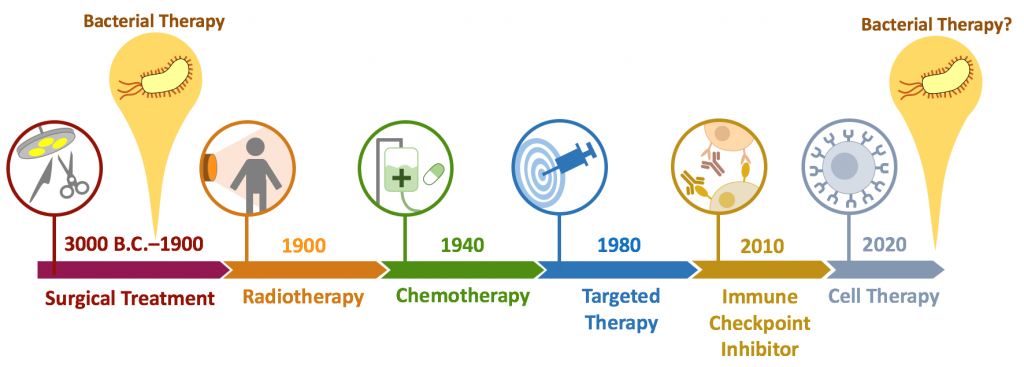
▲圖一 癌症療法簡史。 1891 年為柯立醫生第一次嘗試細菌療法。中間歷經放射治療、化學療法、標靶治療、免疫檢查點抑制劑、細胞療法,如今細菌療法再次進入臨床實驗,有望接棒細胞療法成為下個世代的免疫療法。
以上是人類「主流」的抗癌史,然而歷史上曾經有一個長期被忽視的療法 –「細菌癌症療法」,是由美國醫生柯立 (William Coley) 所研發的一種實驗性療法。有關柯立的故事,本院陶秘華研究員與吳嘉仁博士在 1622 期的院訊中有精彩的敘述,這邊僅摘要幾個重點:柯立醫生在 1891 年,首次嘗試將化膿性鏈球菌 (Streptococcus pyogenes,大家常用的 CRISPR/Cas9 即是來自此菌) 打入病人腫瘤內,將一個接近拳頭大小的頸部肉瘤癌完全消除。其後的 30 年間,柯立醫生致力於使用細菌療法治療超過 1000 位病人,其中有 500 位以上在治療期間達到接近完全緩解 (缺乏後續的追蹤紀錄)。
然而柯立醫生當時並不能解釋細菌療法的機制 (事實上,柯立醫生連癌症生成的機制也不了解,他一直在去世前都以為癌症是由細菌感染造成),他的療法也不被同儕所接受,當時最著名的骨肉瘤權威 James Ewing,曾是柯立在醫院中的上司,公開反對柯立使用細菌療法。後來在放射治療與化學療法的興起下,柯立的細菌療法漸漸為世人所淡忘。有趣的是,在超過一百年以後,科學界發現免疫系統對於癌症治療的重要性,終於能解釋細菌療法的機制,於是尊稱柯立為免疫療法之父。柯立的女兒 Helen Coley Nauts 所成立的 Cancer Research Institute,致力於免疫療法的研究,目前的中心主任就是發現免疫檢查點 CTLA-4 的諾貝爾獎得主 James Allison,算是一個世紀以來免疫療法的星火傳承。
細菌百百種,哪一種治療癌症最好?
近 10 到 20 年來,由於癌症與免疫之間的關係漸漸清楚,細菌癌症療法又捲土重來,科學家們紛紛使用自己最喜歡的菌種來進行癌症治療的實驗。以下就幾種比較熱門且進過臨床試驗的菌種一一簡介:
1.卡介苗 (Bacillus Calmette–Guérin)
卡介苗不是用來預防肺結核的嗎?跟癌症有什麼關係?它可是細菌第一個成功用於治療癌症的藥物!卡介苗起源於一種牛結核菌,自 1908 年起,一對法國科學家 Calmette 和 Guérin 耗費 13 年的光陰,在實驗室中不斷地繼代該菌,終於成功培養出一種弱化的菌種命名為 BCG,可以安全地當作肺結核疫苗在人類身上使用。然而 1959 年一篇 Nature 論文意外地發現,施打過 BCG 的小鼠,竟可以大大延緩腫瘤生長的速度。這個發現後來衍伸出一支藥物叫Onco-BCG,基本上就是卡介苗的成分,但經由膀胱內注射的話,可治療早期膀胱癌或是預防膀胱癌復發。根據統計,膀胱癌的患者如果僅接受 BCG 基礎劑量 (6 針) 的療程,其 5 年復發率有 50%。但如果再施打 7 至 9 針追加劑,可大幅下降復發率至接近 10%。雖然那麼多次療程相當的不便,但是療效十分顯著,患者們一定要打好打滿!
2.鼠傷寒沙門氏桿(Salmonella typhimurium)
S.typhimurium 是一種革蘭氏陰性菌 (gramnegative),它是一種致病菌,常見於人類的食物中毒中,會引起上吐下瀉。革蘭氏陰性菌在外膜上帶有大量脂多醣 (LPS),又稱內毒素 (endotoxin),會引起人類強烈的發炎反應,嚴重可能導致死亡。因此要使用 S.typhimurium 作為癌症治療,必須要先弱化其毒性。科學家將其中一個負責合成 LPS 重要官能機的基因 msbB 剔除,可以大大降低 LPS 的毒性約一百倍。另外,科學家利用腫瘤微環境中含有大量嘌呤的特性,將 S. typhimurium 中一個負責合成嘌呤的基因 purL 剔除,使其偏好在腫瘤內生存。最終, msbB/purL 雙重剔除的菌種命名為 VNP20009,對於小鼠的毒性下降一萬倍,且對小鼠的腫瘤有良好的治療效果。很可惜的是,在後續的臨床實驗中, 24 位接受治療的病人中,僅有 3 位的腫瘤中能觀察到 VNP20009 的生長,並且腫瘤都沒有消退 5。
3.李斯特 (Listeria Monocytogenes)
李斯特菌也是一種會導致食物中毒的細菌,它的毒性相當的強,嚴重的話可能會致死。李斯特菌是一種細胞內病原體(intracellular pathogen),它會入侵人類的吞噬細胞,在細胞內部進行生長繁殖。科學家於是利用此一特性,利用基因轉殖的方式,使李斯特菌表達一種癌症相關抗原 mesothelin。這個蛋白在一般健康細胞幾乎不表達,但在一些癌細胞 (包括胰臟癌、卵巢癌等等) 會大量表達。由於李斯特菌會在抗原呈現細胞內部生長,其表達的蛋白就像寄主細胞自己表達的蛋白一樣,會透過 MHC class I 呈現在細胞表面,進而刺激 CD8+T 細胞的活性,達到類似癌症疫苗的效果。在一個臨床二期的實驗中,科學家利用一種表達 mesothelin 且弱化的李斯特菌 (CRS-207) 治療胰臟癌末期的病人,配合化療與免疫促進劑,其平均生存期達到 9.7 個月,比控制組增長了 5.1 個月的壽命 6。雖然只是數個月的進步,但由於胰臟癌是非常難治療的癌症,其結果仍是相當令人振奮!
4.丁酸梭菌 (Clostridium butyricum)
說到丁酸梭菌大家可能沒什麼印象,但如果改說妙利散,相信許多人都知道。這是一支早在 1933 年由日本研發出的益生菌,其菌株命名為 CBM588。這支益生菌除了平時可用作維護腸道菌相健康以外,由於其對於抗生素有良好的耐受性,可以預防或緩解由抗生素治療所引發的腹瀉問題。另外,近來腦腸軸的臨床研究也發現 CBM588 與抗憂鬱藥物一同服用時,能有效緩解憂鬱症狀。更令人驚奇的是, CBM588 能大幅增加免疫檢查點抑制劑的反應率。今年二月發表在 Nature Medicine 的臨床一期報告顯示,在腎臟癌末期的病人中,如果單獨使用免疫檢查點抑制劑,病人反應率約為 20%,符合一般預期。但如果同時使用免疫檢查點抑制劑加上口服 CBM588,能大幅增加反應率至大約 60%7。這個驚人的發現可能解釋了為什麼過去在免疫檢查點抑制劑的治療中僅有部分病人有效,答案或許不在癌細胞身上,而是在我們的腸道菌當中!
5.大腸桿菌 (Escherichia coli)
最後要介紹給大家最熟悉的菌種,科學家最好的朋友大腸桿菌。有別於上面提到的致病菌,大腸桿菌本來就是人類腸道的共生菌,實驗室常用的 K12 或 strain B 都不會對人類致病。另外有一支大腸桿菌的益生菌叫 Nissle 1917,可以安全口服使用。在小鼠實驗中,大腸桿菌具有極佳的腫瘤標靶性與共生性。如果將植有皮下腫瘤的小鼠以靜脈注射的方式打入大腸桿菌,99% 以上的大腸桿菌都會聚集至腫瘤內生長,其數量可達 108/克腫瘤,相當於腫瘤內的癌細胞數。由於大腸桿菌並非致病菌,在其他器官會被免疫系統完全清除。
另外,大腸桿菌的一大優勢是容易進行基因工程,可以進行許多精密的設計來對抗癌症。例如 2016 年的 Nature 論文中,作者們設計了一個同步化裂解的基因迴路,可以週期性地釋放大腸桿菌中攜帶的抗癌蛋白 8。又如在最近的臨床一期實驗中,科學家設計一個在缺氧環境下會釋放環二核苷酸 (Cyclic di-nucleotides) 的 Nissle 1917(命名為 SYNB1891,向柯立醫生致敬)。環二核苷酸會刺激先天免疫系統中的 STING 訊號,進而促發抗癌的免疫反應。目前臨床資料顯示安全耐受性良好,並且達成目標參與 (target engagement) 與病情穩定 (disease stabilization) 9。
我們的實驗室利用癌細胞依賴 TNF-α 發炎因子的特性,設計出一個免疫毒素 (immunotoxin),能躲藏在 TNF-α 身後進入癌細胞,以特洛伊木馬的方式進行癌細胞毒殺 (圖二)。研究團隊將此免疫毒素放入大腸桿菌中進行癌症治療,證實在小鼠實驗中能大幅度壓抑黑色素瘤的生長 10。
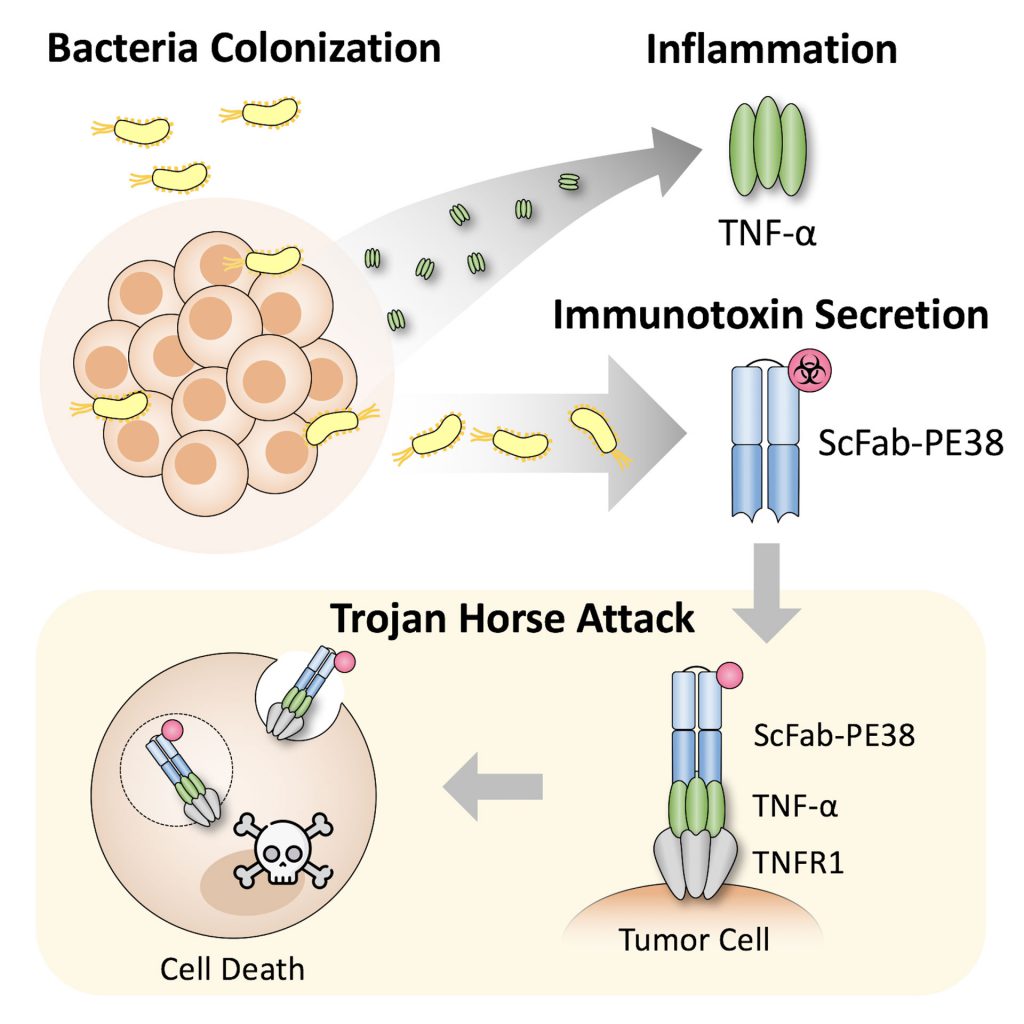
▲圖二 特洛伊木馬細菌療法。我們的研究團隊利用細菌釋放免疫毒素,以木馬屠城記的方式成功毒殺癌細胞。
下一個活的藥物,細菌!?
從柯立醫生 1891 年的嘗試開始,細菌癌症療法已經超過一百年,從臨床試驗到不被 FDA 承認,終於又回到臨床試驗,以現代科學嚴謹的手法真正測試細菌療法是否有效。在這中間一百多年的歷史,人類除了發展出許多治療癌症的方法,也對免疫系統在癌症發展過程所扮演的角色有深刻的了解。如今,免疫療法成為學醫界普遍的共識,免疫檢查點抑制劑與 CAR-T 療法已經在許多癌症病人身上看到痊癒的曙光。細菌癌症療法與 CAR-T 一樣,既是免疫療法也是活的藥物,而且還可能有助於免疫檢查點抑制劑的療效。比起 CAR-T 的個人化療程和有限的複製能力,細菌具有現貨 (off-the-shelf) 以及無限的複製能力,其普及性和價格都比 CAR-T 更有優勢。
在法規方面,美國 FDA 與歐洲藥典委員會紛紛在 2016 與 2019 年給予活菌藥物 (live biotherapeutic product, LBP) 給出定義與指引。根據 2020 年的統計,跟 LBP 相關的專利超過 640 個,相關的新藥臨床測試 (Investigational new drug, IND) 超過 575 個,超過 50 家 GMP 等級的製成公司在摩拳擦掌準備量產 LBP。目前市面尚未有 FDA 核准的 LBP 藥物,但是今年新英格蘭醫學雜誌發表了一個 LBP 的臨床三期結果,該臨床測試使用一種口服的益生菌 SER-109 治療由艱難梭狀芽孢杆菌 (C.difficile) 所引起的感染腹瀉問題。實驗結果顯示 SER-109 的長期反應率達 88%,比起控制組 60% 有顯著進步 11。 SER-109 很有可能在今年被核准成為人類史上第一個上市的 LBP。讓我們也期待某一支或數支細菌能脫穎而出,成為下個世代的抗癌利器!
參考資料:
1.Brentjens, R.J., Riviere, I., Park, J.H., Davila, M.L., Wang, X., Stefanski, J., Taylor, C., Yeh, R., Bartido, S., Borquez-Ojeda, O., Olszewska, M., Bernal, Y., Pegram, H., Przybylowski, M., Hollyman, D., Usachenko, Y., Pirraglia, D., Hosey, J., Santos, E., Halton, E., Maslak, P., Scheinberg, D., Jurcic, J., Heaney, M., Heller, G., Frattini, M. & Sadelain, M. Safety and persistence of adoptively transferred autologous CD19-targeted T cells in patients with relapsed or chemotherapy refractory B-cell leukemias. Blood 118, 4817-4828 (2011).
2.Kochenderfer, J.N., Wilson, W.H., Janik, J.E., Dudley, M.E., Stetler-Stevenson, M., Feldman, S.A., Maric, I., Raffeld, M., Nathan, D.A., Lanier, B.J., Morgan, R.A. & Rosenberg, S.A. Eradication of B-lineage cells and regression of lymphoma in a patient treated with autologous T cells genetically engineered to recognize CD19. Blood 116, 4099-4102 (2010).
3.Porter, D.L., Levine, B.L., Kalos, M., Bagg, A. & June, C.H. Chimeric antigen receptor-modified T cells in chronic lymphoid leukemia. N Engl J Med 365, 725-733 (2011).
4.Melenhorst, J.J., Chen, G.M., Wang, M., Porter, D.L., Chen, C., Collins, M.A., Gao, P., Bandyopadhyay, S., Sun, H., Zhao, Z., Lundh, S., Pruteanu-Malinici, I., Nobles, C.L., Maji, S., Frey, N.V., Gill, S.I., Tian, L., Kulikovskaya, I., Gupta, M., Ambrose, D.E., Davis, M.M., Fraietta, J.A., Brogdon, J.L., Young, R.M., Chew, A., Levine, B.L., Siegel, D.L., Alanio, C., Wherry, E.J., Bushman, F.D., Lacey, S.F., Tan, K. & June, C.H. Decade-long leukaemia remissions with persistence of CD4(+) CAR T cells. Nature 602, 503-509 (2022).
5.Toso, J.F., Gill, V.J., Hwu, P., Marincola, F.M., Restifo, N.P., Schwartzentruber, D.J., Sherry, R.M., Topalian, S.L., Yang, J.C., Stock, F., Freezer, L.J., Morton, K.E., Seipp, C., Haworth, L., Mavroukakis, S., White, D., MacDonald, S., Mao, J., Sznol, M. & Rosenberg, S.A. Phase I study of the intravenous administration of attenuated Salmonella typhimurium to patients with metastatic melanoma. J Clin Oncol 20, 142-152 (2002).
6.Le, D.T., Wang-Gillam, A., Picozzi, V., Greten, T.F., Crocenzi, T., Springett, G., Morse, M., Zeh, H., Cohen, D., Fine, R.L., Onners, B., Uram, J.N., Laheru, D.A., Lutz, E.R., Solt, S., Murphy, A.L., Skoble, J., Lemmens, E., Grous, J., Dubensky, T., Jr., Brockstedt, D.G. & Jaffee, E.M. Safety and survival with GVAX pancreas prime and Listeria Monocytogenes-expressing mesothelin (CRS-207) boost vaccines for metastatic pancreatic cancer. J Clin Oncol 33, 1325-1333 (2015).
7.Dizman, N., Meza, L., Bergerot, P., Alcantara, M., Dorff, T., Lyou, Y., Frankel, P., Cui, Y., Mira, V., Llamas, M., Hsu, J., Zengin, Z., Salgia, N., Salgia, S., Malhotra, J., Chawla, N., Chehrazi-Raffle, A., Muddasani, R., Gillece, J., Reining, L., Trent, J., Takahashi, M., Oka, K., Higashi, S., Kortylewski, M., Highlander, S.K. & Pal, S.K. Nivolumab plus ipilimumab with or without live bacterial supplementation in metastatic renal cell carcinoma: a randomized phase 1 trial. Nat Med 28, 704-712 (2022).
8.Din, M.O., Danino, T., Prindle, A., Skalak, M., Selimkhanov, J., Allen, K., Julio, E., Atolia, E., Tsimring, L.S., Bhatia, S.N. & Hasty, J. Synchronized cycles of bacterial lysis for in vivo delivery. Nature 536, 81-85 (2016).
9.Leventhal, D.S., Sokolovska, A., Li, N., Plescia, C., Kolodziej, S.A., Gallant, C.W., Christmas, R., Gao, J.R., James, M.J., Abin-Fuentes, A., Momin, M., Bergeron, C., Fisher, A., Miller, P.F., West, K.A. & Lora, J.M. Immunotherapy with engineered bacteria by targeting the STING pathway for anti-tumor immunity. Nat Commun 11, 2739 (2020).
10.Hu, C.W., Chang, Y.C., Liu, C.H., Yu, Y.A. & Mou, K.Y. Development of a TNF-alpha-mediated Trojan Horse for bacteria-based cancer therapy. Mol Ther (2022).
11.Feuerstadt, P., Louie, T.J., Lashner, B., Wang, E.E.L., Diao, L., Bryant, J.A., Sims, M., Kraft, C.S., Cohen, S.H., Berenson, C.S., Korman, L.Y., Ford, C.B., Litcofsky, K.D., Lombardo, M.J., Wortman, J.R., Wu, H., Aunins, J.G., McChalicher, C.W.J., Winkler, J.A., McGovern, B.H., Trucksis, M., Henn, M.R. & von Moltke, L. SER-109, an Oral Microbiome Therapy for Recurrent Clostridioides difficile Infection. N Engl J Med 386, 220-229 (2022).